وقتی صحبت از علم پزشکی و درمان میشه، یکی از ستون های اصلی در این حوزه آزمایشگاه و تشخیص هست. قطعا بدون تشخیص دقیق، تجویز دارو و طراحی روش های درمانی کار بسیار دشواری خواهد بود. تست های تشخیص آزمایشگاهی طی دهه های مختلف رشد پیدا کردن و به کمک تکنولوژی های جدید، هم زمان و هم هزینه به ازای هر تست کاهش قابل توجهی داشته. روش های تشخیص بالینی بر اساس بیولوژی مولکولی توسعه داده شدن. در حقیقت طی پروسه های آزمایشگاهی ما به دنبال وجود یا عدم وجود یک ماکرومولکول، یون، باکتری و… در بدن انسان هستیم. بسته به شرایط فرد، نتایج به دست اومده می تونن متفاوت تفسیر بشن. تفسیرهایی که اساس پروسه های درمانی بعدی خواهند بود. البته که بحث تست های تشخیص آزمایشگاهی صرفا منتهی به بالین نمیشه و آزمایشگاه های تحقیقاتی هم بهره زیادی از تست های تشخیصی می برن.
در این مقاله قصد دارم پیرامون اساس روش های مختلف آزمایشگاهی و استراتژی های موجود به منظور شناسایی یک مولکول هدف اشاره کنم. روش هایی که آگاهی از اون ها برای هر محقق در حوزه های پزشکی و زیستی می تونه مفید باشه.
فرقی نداره هدف پژوهش باشه یا تولید، دونستن تئوری آغاز مسیر هست.
سه اتفاق اساسی در توسعه تست های تشخیص آزمایشگاهی
- کشف اهمیت پروتئین در حیات و اهمیت DNA به عنوان ماده ژنتیکی
- کشف ساختمان DNA
- پروژه ژنوم انسان به دنبال ابداع تکنیک PCR
این سه اتفاق مهم در تاریخ بیولوژی سبب شکل گیری پایه و اساس بیولوژی مولکولی شدن. حوزه ای که به شناخت بهتر پدیده های بیولوژیکی در بدن انسان کمک زیادی داشت. وقتی بتونیم شرایط نرمال رو درک و عوامل بیماری زا رو شناسایی کنیم، طراحی روش های مختلف برای تشخیص بیماری ها تسهیل خواهد شد.
تا قبل از ظهور تست های تشخیصی آزمایشگاهی، پروسه فهم و درک بیماری بر اساس تجربیات بالینی و توجه به علائم بیمار بود. اما شکل گیری بیولوژی مولکولی، به محققین اجازه داد روش هایی رو طراحی کنن که قادر به شناسایی پروتئین ها، آنزیم ها، هورمون ها و لیپیدهای موجود در بدن انسان باشن. همچنین طی سالیان اخیر و با پیشرفت های حاصل شده در علوم تشخیصی، نوکلئیک اسیدها به عنوان یک هدف مهم در تشخیص بیماری ها و عفونت های متعدد در نظر گرفته شدن. همچنین بسیاری از پژوهش ها به شناسایی دقیق توالی های اسید نوکلئیکی وابسته هستن.
یه نکته مهم اینه که خروج از حالت نرمال در سطح مولکول منجر به پدیدار شدن بیماری های مختلف میشه. پس توجه به فرآیندهای مولکولی و شناخت هرچه بهتر اون ها یک عامل اساسی در توسعه هرچه بهتر روش های تشخیصی هست. قبل از بررسی روش های مختلف آزمایشگاهی، خوبه که یکم پیرامون مکانیسم مولکولی بیماری ها صحبت کنیم.
مکانیسم مولکولی بیماری ها
بروز و پیشرفت بسیاری از بیماریهای انسانی مثل لوسمی، تومورهای بدخیم، دیابت، بیماریهای عصبی، بیماریهای قلبی عروقی، بیماری های مغزی و حتی فشار خون بالا به ساختار، عملکرد و برهمکنش غیرطبیعی پروتئینها و کمپلکسهای اون ها مربوط میشن. با بررسی مکانیسم مولکولی بیماری ها ممکنه مشاهده کنیم که در ساختار ژن تغییراتی ایجاد شده. این احتمال وجود داره که پروسه بیان ژن متاثر از عوامل تنظیم کننده سلولی یا سایر عوامل، به شکل نامتعارفی پیش بره. ممکنه مشکل به واسطه ژن های بیماری زا خارجی باشه و یا پردازش غیر صحیح پس از ترجمه و تخریب پروتئین ها به دلایل مختلف، سبب بروز بیماری بشن.
با توجه به اینکه پروتئین ها مولکول های اجرایی در زندگی و حیات هستن، خطا حین رونویسی، ترجمه و نهایتا تخریب پروتئین ها، هرکدوم می تونن منجر به بروز بیماری های مختلف بشن.
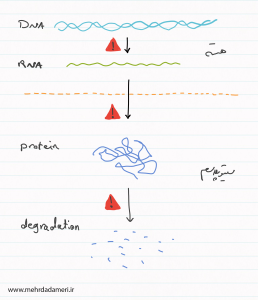
با توجه به نکات مطرح شده، می تونیم نتیجه بگیریم که پیشرفت های حاصل در بیولوژی مولکولی، امروز ما رو قادر به طراحی روش های مختلف تشخیصی کردن. برای تشخیص هریک از مناطق دچار مشکل در سلول، امروزه استراتژی های مختلفی وجود دارن که در ادامه پیرامون اون ها صحبت خواهیم کرد.
روش های تشخیص اسید نوکلئیک
طراحی تست های تشخیصی آزمایشگاهی مبتنی بر تشخیص توالی های اسید نوکلئیکی طی سالیان اخیر بین پژوهشگران محبوبیت بالایی پیدا کرده. تکنیک های رایج برای تشخیص اسید نوکلئیک شامل موارد زیر هستن:
- تکثیر توالی اسید نوکلئیک (Amplification)
- توالی یابی (Sequencing)
- هیبریداسیون اسید نوکلئیک (Hybridization)
- روش مبتنی بر تراشه (Chip-based)
- حسگر زیستی (Biosensor)
تکثیر توالی اسید نوکلئیک (Amplification)
در این روش، یک قطعه توالی اسید نوکلئیکی (DNA یا RNA) به صورت انتخابی تکثیر خواهد شد. متداول ترین روش مورد استفاده برای تکثیر توالی اسید نوکلئیکی، واکنش زنجیره ای پلیمراز (PCR) هست. طی واکنش PCR یک قطعه توالی هدف به واسطه پرایمرهای Forward و Reverse و همچنین آنزیم DNA پلی مراز مقاوم به حرارت تکثیر خواهد شد. طی این واکنش به علت چرخه ای بودن فرآيند، طی هر سیکل محصولات دو برابر سیکل قبلی میشن. در حقیقت محصولات به صورت تصاعدی در حال افزایش خواهند بود.
تکثیر تصاعدی مهم ترین مزیت واکنش زنجیره ای پلی مراز هست، چون در مدت زمان نسبتا منطقی و کوتاه (معمولا ۲ ساعت) ما رو به تعداد قابل توجهی از توالی مورد هدفمون میرسونه. امروز از PCR به کررات در آزمایشگاه های مختلف تشخیص طبی و تحقیقاتی استفاده میشه. در پاندمی کرونا، این تکنیک (البته نوع پیشرفته ای از اون تحت عنوان qRT-PCR) نقش حیاتی رو ایفا کرد.
توالی یابی (Sequencing)
فناوری توالی یابی، طی سالیان اخیر نقش مهمی رو در فهم بهتر بیولوژی ارگانیسم های مختلف ایفا کرده. هر ارگانیسم ژنوم منحصر به فرد خودش رو داره. علی رغم تشابهاتی که بین ژن های ارگانیسم های مختلف وجود دارن، تفاوت های کلیدی در ژنوم هر موجود دیده میشه. علی رغم کاربردهای مهم تحقیقاتی این فناوری، تست های تشخیصی آزمایشگاهی (بالینی) هم از این تکنیک بهره زیادی بردن. در مورد انسان، با مشخص شدن توالی ژن های مختلف و شناسایی توالی طبیعی اون ژن، فهم تغییرات در ساختار ژن و بروز بیماری های مختلف تسهیل خواهد شد.
طی سالیان مختلف نسل های جدید توالی یابی توسعه داده شدن و امروز در مدت زمان کوتاه، میتونیم ژنوم کامل رو توالی یابی کنیم. در حالی که این امر در گذشته، ممکنه بود ماه ها و حتی سال ها زمان ببره. امروز تعیین توالی DNA و RNA تکنیک های رایجی در بسیاری از مطالعات و همچنین آزمایشگاه های بالینی هستن. با توجه به اهمیت توالی ژن ها و جهش های تک نوکلئوتیدی که می تونن بیماری های متعددی رو ایجاد کنن، توجه به این تکنولوژی و توسعه روش های با بازدهی بالاتر و البته هزینه مقرون به صرفه تر، همچنان ضروریه.
هیبریداسیون اسید نوکلئیک (Hybridization)
فناوری هیبریداسیون اسید نوکلئیک یکی از تکنیک های پایه ای در زیست شناسی مولکولی هست. این تکنیک طی سالیان اخیر استفاده گسترده ای در حوزه های مختلف داشته و روش های تشخیصی مبتنی بر هیبریداسیون دارای مزیت حساسیت، اختصاصیت و سرعت قابل توجه هستن. هیبریداسیون بر اساس مکمل شدن دو توالی اسید نوکلئیکی تک رشته ای و تشکیل یک رشته دوتایی شکل گرفته.
در کارهای تشخیصی به واسطه یک پروب نشان دار شده که قابلیت اتصال اختصاصی به ناحیه ای از ژن هدف رو داره، می تونیم تست های مختلفی رو طراحی کنیم. به طور مثال، هدف ما یک ژن ویروسی هست. با طراحی پروب نشان دار و انجام آزمایش، در صورتی که پروب به ژن هدف متصل و سیگنال تولید بشه، حضور ویروس در نمونه مشخص خواهد شد. اگر دوست دارید پیرامون این تکنیک بیشتر مطالعه کنید این مقاله می تونه انتخاب مناسبی باشه.
روش مبتنی بر تراشه (Chip-based)
در حال حاضر، تکنولوژی مبتنی بر تراشه برای تشخیص اسیدهای نوکلئیک عمدتا فناوری gene chip هست. این تراشه ها تحت عنوانین زیر هم شناخته میشن:
- DNA chips
- DNA arrays
- cDNA chips
- DNA microarrays
- Oligonucleotide arrays
فناوری تراشه ژن ترکیبی بین رشته ای از علوم زیست شناسی مولکولی، میکروالکترونیک، فیزیک، شیمی و علوم کامپیوتر هست. به طور کلی، تعداد زیادی پروب در سطح تراشه قرار گرفتن که هر کدوم از اون ها قادر به اتصال و شناسایی یک ژن به خصوص هستن. تکنولوژی میکرواری تحول بسیار عظیمی رو در بیولوژی و پزشکی ایجاد کرده. به کمک این تکنولوژی ما می تونیم در بازه زمانی کوتاه، الگوی بیان ژن های یک سلول (چیزی حدود ۵۰ هزار ژن در بعضی تراشه ها) رو به دست بیاریم. سیستمز بیولوژی از میکرواری استفاده گسترده ای برده. البته RNA sequencing یک رقیب برای این تکنولوژی به حساب میاد که مزایای خودش رو داره.
درسته که تراشه های ژنی بالغ ترین و اولین محصول تجاری سازی شده در فناوری Biochip هستن، اما شاید براتون جالب باشه که طی سالیان اخیر با توسعه مفهومی تحت عنوان آزمایشگاه روی تراشه (Lab On a Chip)، ما می تونیم تراشه هایی رو طراحی کنیم که قابلیت انجام PCR و تکثیر توالی اسید نوکلئیکی رو دارن. آینده آزمایشگاه ها با توسعه بیشتر این مفهوم خیلی جذاب خواهد شد.
حسگر زیستی (Biosensor)
بیوسنسورها یا حسگرهای زیستی، مبتنی بر به دام انداختن مولکول هدف به واسطه یک بیورسپتور هستن. بیورسپتور می تونه از جنس آنتی بادی، آنتی ژن، توالی نوکلئیک اسیدی و حتی سلول کامل باشه. بعد از به دام افتادن مولکول هدف، پاسخ بیولوژیکی توسط یک مبدل (Transducer) تبدیل به یک سیگنال قابل اندازه گیری خواهد شد. از مزایای بیوسنسورها میشه به موارد زیر اشاره کرد:
- حساسیت بالا
- اختصاصیت بالا
- سرعت تشخیص
- هزینه تولید پایین
- هزینه مقرون به صرفه برای بیمار
- عدم نیاز به دانش تخصصی جهت انجام تست
- قابل حمل و نقل بودن (Portable) بسیاری از پلتفورم های بیوسنسوری
تست سنجش قند خانگی یک مثال مناسب از بیوسنسورهاست. این پلتفورم های تشخیصی طی سالیان اخیر محبوبیت بالایی بین پژوهشگران پیدا کردن و در آینده نزدیک تست های بیشتری مبتنی بر بیوسنسورها در آزمایشگاه های تشخیص طبی مشاهده خواهد شد. با توجه به مزایای بیوسنسورها که بالاتر اشاره کردم، این پلتفورم های تشخیصی یک کاندید مناسب برای انجام تست های غربالگری اولیه هستن. شناسایی توالی های اسید نوکلئیکی بدون نیاز به تکثیر و انجام PCR، از موضوعاتی هست که به کررات در مقالات مختلف دیده میشه. هیچ بعید نیست که در آینده، آزمایشگاه ها برای غربالگری اولیه و شناسایی DNA و RNA از بیوسنسورها استفاده کنن.
روش های تشخیص پروتئین ها
برای سالیان متعدد، پروتئین ها یک مولکول هدف محبوب برای توسعه تست های تشخیص آزمایشگاهی بودن. هم در آزمایشگاه های تشخیص طبی و هم تحقیقاتی، پروتئین ها یک مولکول مهم هستن و بخش زیادی از مطالعات رو شامل میشن. در حال حاضر، تست های تشخیص آزمایشگاهی رایج برای شناسایی پروتئین ها شامل موارد زیر هستن:
- طیف سنجی نوری
- تراشه پروتئین (Protein chip)
- سنجش ایمنی برچسبگذاری شده (Labeled immunoassay)
- طیفسنجی جرمی (Mass spectrometry)
طیف سنجی نوری
در این روش از دستگاهی به نام اسپکتروفوتومتر استفاده میشه. اسپکتروفتومتری یک روش استاندارد و ارزان قیمت برای اندازه گیری جذب نور یا مقدار ماده شیمیایی در یک محلول هست. در این روش پرتو نور از نمونه عبور داده میشه. ترکیب موجود در محلول، نور رو در طول موج خاصی جذب یا منتقل می کنه. در آزمایشگاه های تشخیص طبی در بخش بیوشیمی، این روش بسیار پرکاربرد هست. طی سالیان اخیر دستگاه های اسپکتروفوتومتر با قابلیت های متفاوتی طراحی و وارد بازار شدن.
تراشه پروتئین (Protein chip)
این تکنولوژی در حقیقت اشاره به Protein microarray داره. این تراشه ها در مطالعات مرتبط با پروتئومیکس کاربرد گسترده ای دارن. از اونجایی که DNA microarray در مطالعات مرتبط با ترنسکریپتومیکس مورد استفاده قرار میگیرن، به کمک تراشه پروتئینی، میشه خلاء ارتباط بین ترنسکریپتوم و پروتئوم رو برطرف کرد. البته نسبت به تراشه های ژنی، این تراشه ها کمتر مورد استفاده قرار گرفتن. اما به طور کلی، در مطالعات غربالگری بیان ژن، تشخیص آنتی ژن و آنتی بادی، تشخیص واکنش بیوشیمیایی و غربالگری دارو از تراشه های پروتئینی استفاده میشه. از مزایای مهم این روش میشه به امکان تشخیص سریع با مقادیر کمی از نمونههای بیولوژیکی (سرم، ادرار، مایعات بدن و غیره) اشاره کرد.
سنجش ایمنی برچسبگذاری شده (Labeled immunoassay)
این نوع سنجش یک اصطلاح کلی برای دسته بزرگی از فناوریهای تشخیصی فوق حساس و با اختصاصیت بالا هست. به دلیل مزایای منحصر به فرد Labeled immunoassay، این روش کاربرد گسترده ای در پزشکی و تشخیص آزمایشگاهی بالینی داره. نکته قابل توجه اینه که اصول اولیه Labeled immunoassay یکسان هست. تفاوت در نحوه تشخیص سینگال های تولیدی و لیبل های مورد استفاده هست. روش های مختلفی مبتنی بر سنجش ایمنی برچسب گذاری شده در مقالات گزارش شدن. برخی از متداول ترین و پرکاربردترین روش های ابداع شده به شرح زیر هست:
- Radioimmunoassay (RIA)
- Enzyme immunoassay (EIA)
- Fluorescence immunoassay (FIA)
- Time-resolved fluoroimmunoassay (TRFIA)
- Chemiluminescence immunoassay (CLIA)
طیفسنجی جرمی (Mass spectrometry)
این روش بر اساس تجزیه و تحلیل نسبت جرم به بار (m/z) یون های یک نمونه هست. در ابتدا نمونه باید یونیزه بشه و در ادامه یون ها با نسبت جرم به بار (m/z) و رفتار حرکتی متفاوت شون در میدان الکتریکی یا مغناطیسی جدا میشن. این روش به علت گران قیمت بودن معمولا در همه جا قابل دسترس نیست. اما از اونجایی که طیف سنجی جرمی دارای مزایای حساسیت بالا، مصرف کم نمونه، سرعت آنالیز سریع، جداسازی و شناسایی همزمان هست، به طور گسترده در حوزه های مختلفی مورد استفاده قرار گرفته. از جمله شیمی، مهندسی شیمی، مواد، محیط زیست، زمین شناسی، انرژی و پزشکی.
آینده تست های تشخیص آزمایشگاهی
روند پیشرفت در تست های تشخیصی همواره در جهت کاهش زمان، هزینه، افزایش حساسیت و اختصاصیت بوده. مسلما تمایل به پیشرفت بشریت و حس ماجراجویانه اکثر محققین به همین مقطع و تست های موجود منتهی نخواهد شد. به نظر من تلفیق حوزه های مختلف تشخیصی با علوم کامپیوتر، هوش مصنوعی و حتی رباتیک می تونن پروسه های جذابی رو خلق کنن. پزشکی فرد محور و حوزه های مرتبط با اون، تست های تشخیصی رو هم تحت شعاع قرار دادن. نیاز به سنجش های مبتنی بر omics و microarray بیشتر حس میشه و به طور کلی افزایش بازدهی و احاطه هرچه بیشتر بر فعل و انفعالات مولکولی داخل سلول می تونن غالب بر صرفا سنجش های موضعی بشن.
چقدر این نوشته برات مفید بود؟
از ۱ تا ۵ امتیاز بدید
میانگین رتبه 4.5 / 5. تعداد رای: 2
هنوز امتیازی ثبت نشده، اولین نفر باشید.

یک پاسخ